Innehållsförteckning
Gramfärgning – metoden
Hur gör man? En snabbgenomgång!
Metoden för att gramfärga ett preparat kan delas in i 6 steg. Tiderna för hur länge varje lösning ska verka varierar mellan olika tillverkare och är ungefärliga.
Kulturen och olika medier
Bakterierna som ska färgas in kan växa i en lösning eller på fast medium. Om bakterierna finns i en lösning kan denna droppas direkt på ett objektglas. Används ett fast medium tar man en renodlad koloni och löser/stryker ut denna i sterilt vatten (NaCl 0,9 %). Låt torka.
Fixering 🔥
Fixera preparatet genom att föra glaset över en gasollåga några gånger. Tänk på att bränna under ifrån och använd peang.
Färg 1 – kristallviolett 🟣
Droppa på kristallviolett och låt verka i 30 sekunder. Skölj försiktigt av färgen med kranvatten.
Jod 🟡
Droppa på jodlösning och låt verka i 60 sekunder. Skölj försiktigt bort lösningen med kranvatten.
Avfärgning ⚪️
Flöda försiktigt med alkohol (etanol) tills det som rinner av börjar bli färglös. Skölj försiktigt med kranvatten.
Färg 2 – safranin 🔴
Motfärga genom att droppa på safranin och låt verka i cirka 15 – 30 sekunder. Skölj försiktigt med kranvatten en sista gång. Låt torka eller tryck försiktigt på glaset med ett filterpapper.
Preparatet färdigt för att undersökas i ljusmikroskop!
Varför välja gramfärgning?
Huvudsyftet med att färga in bakterier är att få veta mer om vilken bakterie det kan röra sig om. Det finns många andra sätt att ta reda på det och för det allra mesta måste olika metoder användas tillsammans. Att använda färgning som metod är dock extra praktiskt när man t ex odlar bakterier i en lösning, som vid blododling vid misstänkt bakteriemi/sepsis. Man har då inte möjlighet att varken titta på koloniers växtsätt eller lukta på dem. Eftersom bakteriemi kan vara ett livshotande tillstånd är det förstås bråttom och vi vill kunna berätta mer om vilken patogen det kan röra sig om så fort som bara möjligt.
Bakterier kan förstås färgas med olika färgningar. Några exempel är metylenblått, kristallviolett, karbolfuchsin och safranin. De två viktigaste och mest använda är utan konkurrens gramfärgning och syrafast färgningsteknik. Båda har samma principer: infärgning, avfärgning och motfärgning.
Gramfärgning är grunden inom bakteriologisk färgningsteknik men det finns vissa bakterier där metoden inte fungerar särskilt väl. T ex så kommer kristallviolett inte igenom det vaxiga yttre höljet som mykobakterier har. De kallas därför syrafasta (stavar). Det finns också bakterier som räknas som gramlabila, gramvariabla, gramneutrala mm. Mer om dessa kommer vi återkomma till i delen om gramfärgningsresultatet.
Anledningen till att färgningen ändå är så pass populär fortfarande, nästan 140 år efter att den först uppfanns av Hans Christian Gram, är att man med metoden kan dela in en oerhört stor andel av för människan intressanta bakterier i två olika läger: grampositiva och gramnegativa. Gramfärgningen är en så kallad differentialfärgning. Med hjälp av denna indelning kan man t ex göra en del antaganden om hur bakterien kommer att reagera på olika antibiotika.
Läs gärna också artikeln om den prokaryota cellväggen och om hur dess uppbyggnad är avgörande för gramfärgningsresultatet.
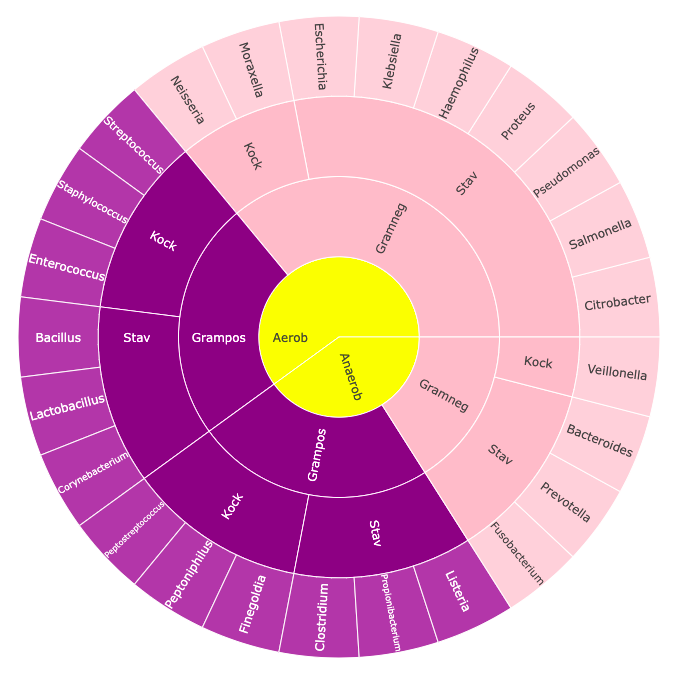
Färgningen ger dessutom snabb information om cellernas form (morfologi) som också ger viss ledning till svaret på vilken bakterie det kan röra sig om. Vetskap om dessa faktorer tillsammans med information om vilken miljö de växt fram i gör det möjligt att ganska snabbt avgränsa urvalet till ett mindre antal möjliga släkten. Man kan t ex använda sig av ett solskendiagram (figur 1) som du via länken kan lära dig göra själv med Python och Plotly.
Gramfärgningens huvudingredienser
I färgningen ingår 4 lösningar (exklusive kranvatten): kristallviolett (mörklila), jodlösning (gul), alkohol (färglös) och safranin (rosa). Figur 2 visar en schematisk bild över hur färgen i ett preparat med grampositiva respektive gramnegativa bakterier kommer att se ut. I mitten, bredvid namnet på respektive lösning, visas en droppe som symboliserar lösningens färg.
Efter fixering kommer således båda preparaten se färglösa ut. När kristallviolett tillsats blir båda glasen blå/mörklila. Efter tillsats av jod blir båda preparaten möjligen något mera lila. (Ibland beskrivs grampositiva bakterier som blå och -negativa som röda, vilket är något jag inte håller med om.) Först vid avfärgning med etanol/aceton kommer glasen att skilja sig åt: preparetet med de grampositiva bakterierna kommer att behålla sin lila färg medan de gramnegativa åter blir färglösa. När man till sist droppar på motfärgen safranin kommer de gramnegativa cellerna färgas rosa.

Kristallviolett
Kristallviolett (KV, även kallad gentianaviolett) löses i vatten upp i positiva respektive negativa joner. Dessa joner tar sig igenom både grampositiva och gramnegativa bakteriers cellvägg och cellmembran. De positiva jonerna samspelar med de negativt laddade komponenterna i bakterierna och cellerna färgas lila.
Jodlösning
Jodlösningen består av jod och kaliumjodid. Jodet (I– eller I3–) samspelar med de positiva jonerna av kristallviolett och bildar stora komplex (KV – I). Dessa komplex fastnar i de inre och yttre lagren av bakteriecellen.
Alkohol
Alkohol i form av 95 %-ig etanol eller 30 %-ig aceton kan användas. Det går också bra att använda lika delar etanol och aceton tillsammans. Alkoholens/acetonets funktion är avfärgning. Den gramnegativa bakteriens yttermembran går sönder och peptidoglykanlagret lämnas helt exponerat. Komplexet av kristallviolett och jod kommer att sköljas bort tillsammans med yttermembranet. Den grampositiva cellen blir dehydrerad (uttorkad) av lösningsmedlet/avfärgningen. De stora komplexen fastnar då bland peptidoglykanets många lager.
Safranin
Efter avfärgning är de grampositiva bakterierna fortfarande lila, de har inte avfärgats. De gramnegativa har dock tappat den lila färgen. Safranin används därför som motfärgning för att kunna se även dessa. Safranin är en positivt laddad färg som gör de gramnegativa cellerna rosa. Färgen kommer bara syns hos de celler som avfärgats. Karbolfuchsin kan också användas med liknande resultat.
Referenser
Brauner, Arvidson, Blomberg. Medicinsk mikrobiologi och immunologi. 1:a uppl. Vol. 2015. Studentlitteratur;
Coico R. Gram Staining. Current Protocols in Microbiology. 2006;00(1):A.3C.1-A.3C.2.
Hardy J. Gram’s Serendipitous Stain [Internet]. 2016 [citerad 17 oktober 2021]. Tillgänglig via: https://hardydiagnostics.com/wp-content/uploads/2016/05/Hans-Christian-Gram.pdf.
Ryan, Nafees, Alspaugh. Sherris Medical Microbiology. 7:e uppl. Vol. 2018. McGraw-Hill Education;